Наноструктурированные металлоксидные функциональные материалы
Руководитель группы – доктор химических наук Авдин Вячеслав Викторович
Краткая историческая справка
Сущность исследований
Области применения металлоксидов
Что удалось получить?
Какие перспективы?
Оборудование для исследования
Сущность исследований
Сначала о терминологии. Термин «наноматериалы» возник в конце 80-х годов для того, чтобы отделить исследования, связанные с ультрадисперсными системами от исследований, связанных с высокоструктурированными ультрадисперсными системами. Обычными ультрадисперсными системами занималась коллоидная химия приблизительно с начала XIX века. Нанодиапазон, согласно ИЮПАК, простирается от 1 до 100 нм, и ультрадисперсные (т. е. коллоидные) частицы как раз в него попадают. Это гидрозоли, сольвозоли, аэрозоли. К наноматериалам можно отнести и целлюлозу, которая имеет размер волокон, попадающий в нанодиапазон, и активированный уголь, получаемый из целлюлозы. Но разве можно приравнять целлюлозу, у которой сечение трубок меняется на порядок по длине, и углеродную нанотрубку, имеющую ровную структуру на атомарном уровне? По сути для различия этих классов веществ и было введено понятие «наноматериалы».

Долгое время «наноматериалы» ассоциировались с высокими технологиями, наивысшими достижениями в материаловедении, и, в общем, так и было. Но в 90-х годах начала развиваться индустрия микросхем. Появилась 100-нанометровая, затем 90-, 80-, 70-ти и далее по уменьшению размера, технология. Названия этих технологий соответствуют ширине токоведущих дорожек в микросхеме. Ширина определяет размеры и производительность микросхем. Дорожки не идеальны на атомарном уровне, и формально (по старому определению), это не наноматериалы. Но не отнести эти технологии к высоким, тоже нельзя. Подобные обстоятельства (и аналогичные в других областях техники и технологий) заставили отнести к наноматериалам все объекты, имеющие размер, хотя бы по одному измерению, в диапазоне 1…100 нм. Нанообъекты подразделяют на наноточки (или квантовые точки), наностержни/нанотрубки и нанолисты. Таким образом, и целлюлоза с активированным углём, и ультрадисперсные золи (коллоидные растворы) попали в разряд наноматериалов.
Наноразмерный уровень в гетерогенных катализаторах нужен для обеспечения высокой поверхности в системе для более полного взаимодействия с субстратом. Можно получить катализатор с размерами зёрен и 20, и 10 нм. Но говорить о том, что (фото)каталитическая активность будет расти пропорционально уменьшению размера частиц, не приходится. Причин несколько – увеличивается дефектность структуры, растёт процент рекомбинации пар «электрон-дырка» (для фотокатализаторов) и пр.
Что такое «металлоксиды»? Из курса школьной химии известно, что если к раствору соли переходного металла прилить щёлочь, образуется осадок:
Mx(An)y + NaOH → M(OH)y↓ + Na+ + An–,
где M – переходный металл, An – анион (приведена схема взаимодействия, без расстановки коэффициентов). К переходным металлам относятся большая часть химических элементов Периодической системы Д.А. Менделеева, начиная с четвёртого периода и ниже, кроме щелочных и щелочноземельных металлов, благородных газов, галогенов и халькогенов. Из последних теллур и полоний также относятся к переходным металлам. Сюда же следует отнести алюминий и кремний из третьего периода.
Прокаливание гидроксида M(OH)y приводит к образованию оксида:
M(OH)y→MOy/2 + H2O↑
В классических представлениях есть ещё упоминание о том, что свежеосаждённый гидроксид и состаренный отличаются по свойствам (произведение растворимости, сорбционная активность, количество удерживаемой внутри осадка воды и пр.).
Оксид MOy/2 и есть металлоксидный материал. Вроде бы всё просто и что здесь изучать?
На самом деле процессы протекают несколько иначе.
Почему добавление щёлочи к раствору соли переходного металла приводит к выпадению осадка, а непереходного – нет? Так же из школьного курса химии известно, что после растворения соли в воде происходит электролитическая диссоциация. Например, для сульфата алюминия это будет выглядеть следующим образом:
Al2(SO4)3 ↔ 2Al3+ + SO42–.
Далее происходит гидратация ионов. Сульфат-ион гидратируется слабо, так как он является анионом сильной кислоты. А ион алюминия гидратируется хорошо, так как он является катионом слабого основания:
Al3+ + kH2O ↔ [Al(H2O)k]3+
Все переходные металлы являются катионами слабых оснований, поэтому подобные реакции можно написать для всех них.
Молекулы воды вокруг иона алюминия взаимодействуют с ним по донорно-акцепторному механизму и образуют гидратную оболочку. Частица [Al(H2O)k]3+ фактически является комплексом, поэтому k–координационное число (КЧ). kобычно принимает значения от 4 до 6 и зависит как от типа металла, так и от температуры, ионной силы раствора и пр.
После гидратации начинается процесс гидролиза, который заключается в том, что от одной из молекул воды отщепляется ион водорода (между молекулами постоянно идёт обмен ионами водорода). Заряд частицы [Al(H2O)k]3+ снижается, что энергетически более выгодно, поэтому ион водорода назад не возвращается, а тут же гидратируется – присоединяется к одной из молекул воды. Следует отметить, что в школьных (да и университетских) учебниках часто пишут об образовании иона оксонияH3O+. На самом деле такого иона в жидкой воде не может образоваться в принципе. Вода даже в парообразном состоянии содержит немного одиночных молекул воды, а в жидкости их вообще нет. Даже в условиях масс-спектрометра, где разряжение 10–2 Па и температура 250°С регистрируются примерно равные ионные токи одиночных и димерных молекул воды (H2O)2. Наиболее вероятная частица, образующаяся при взаимодействии иона водорода с водой – H5O2+. Гидратация в целом идёт в три стадии:
(1) [Al(H2O)k]3+ + 2H2O ↔ [Al(ОН)(H2O)k–1]2+ + Н5O2+,
(2) [Al(OH)(H2O)k–1]2+ + 2H2O ↔ [Al(ОН)2(H2O)k–2]+ + Н5O2+,
(3) [Al(OH)2(H2O)k–1]+ + 2H2O ↔ [Al(ОН)3(H2O)k–3]0 + Н5O2+,
но без добавления щёлочи, вторая и третья стадии почти не реализуются. А если щёлочь прибавлять, то ионы водорода будут нейтрализовываться и равновесия (1) – (3) будут сдвигаться вправо. Частицы, образующиеся в реакциях (2) и (3) (соответственно [Al(ОН)2(H2O)k–2]+ и [Al(ОН)3(H2O)k–3]0) будут вступать во взаимодействие друг с другом. Для трёхвалентных металлов это будет выглядеть так:
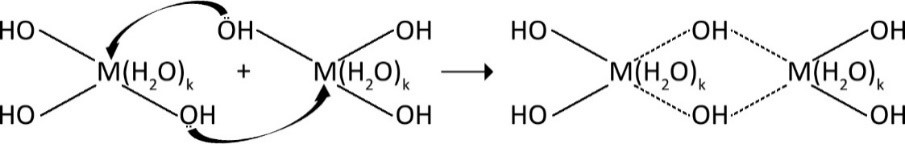
где M – трёхвалентный металл, пунктиром показаны донорно-акцепторные связи.
Для некоторых металлов (например, Ptи Pd) в подобное взаимодействие будут вступать уже продукты первой стадии гидролиза.
Таким образом, в результате прибавления щёлочи к раствору переходного металла образуется полимер, в котором звеньями выступают гидратированные гидролизованные атомы металла:
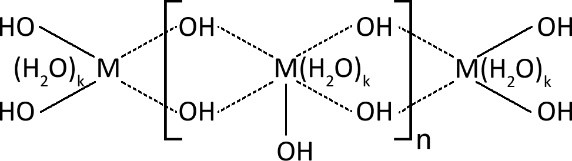
Донорно-акцепторные связи, обозначенные пунктиром, равноценны и имеют один порядок. Это было установлено ещё в прошлом веке различными методами. Это обстоятельство важно потому, что до образования полимерной цепи ОН-группы были ковалентно соединены с одним атомом металла. То есть после образования связи M–OH–M произошло перераспределение электронной плотности и связи стали равноценными. Такие связи называют мостиковыми. ОН-группы, не входящие в мостиковые связи называются свободными или концевыми. Они являются сорбционными и/или ионообменными центрами.
При большой длине полимерной цепи образуется слоистая или волокнистая структура, где пространство между полимерными цепями заполняется водой (если синтез ведётся в водном растворе). Эта вода также может координационно связываться с концевыми ОН-группами и за счёт этого удерживаться в структуре. Но не следует забывать, что в водной среде ОН-группы могут диссоциировать. В кислой области может от полимерной цепи отщепляться вся ОН-группа, в щелочной – ион водорода. Это приводит к тому, что поверхность металлоксида в кислой среде заряжена положительно, а в щелочной отрицательно. Заряд компенсируется противоионами, находящимися в пространстве между полимерными цепями. Противоионы могут быть как ОН–, так и другие ионы, в частности, ион исходной неорганической соли, из которой осуществлялся синтез, а также карбонат–ион. Карбонат-ионы неизбежно присутствуют в водном растворе, так как углекислый газ, присутствующий в воздухе, хорошо растворяется в воде. Таким образом, внутренние области металлоксида заполняются как ОН–, так и другими ионами. YuanzhouXiиRobert J. Davis в 2010 г. предложили такуюструктуру подобного соединения:
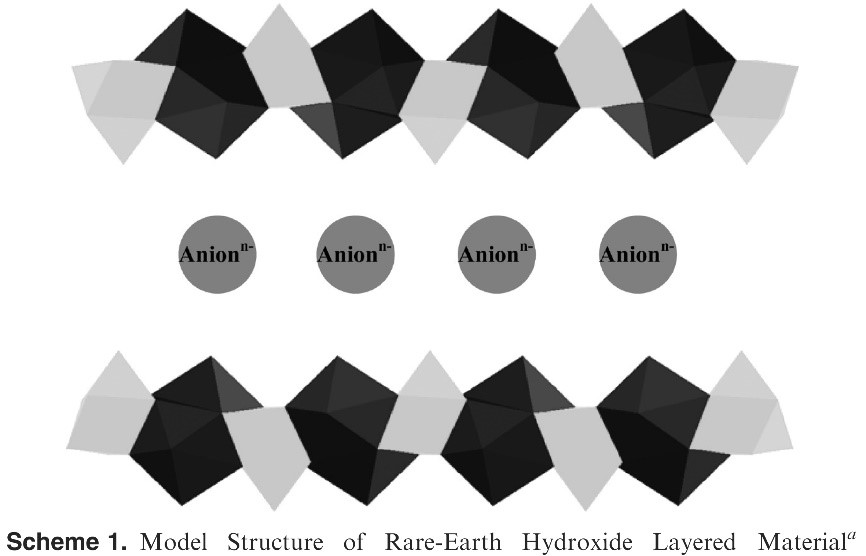
Если данную схему изобразить в виде химической структуры, то это будет выглядеть примерно так:
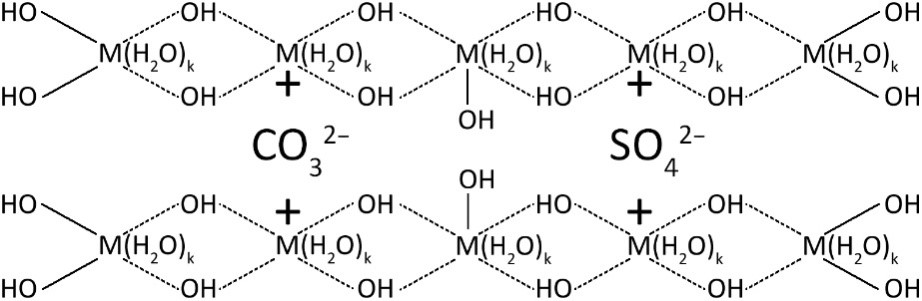
Гидрогель после получения отмывают дистиллированной водой. Процедура отмывки выглядит следующим образом: гидрогель декантируют или фильтруют, переносят в пробирку для центрифуги, заливают водой, интенсивно встряхивают, центрифугируют. Процедуру повторяют до тех пор, пока в фугате перестанут обнаруживаться противоионы исходных солей. Тем не менее, из термоаналитических и масс-спектрометрических кривых видно, что отмывка не позволяет избавиться от противоионов, находящихся внутри структуры:
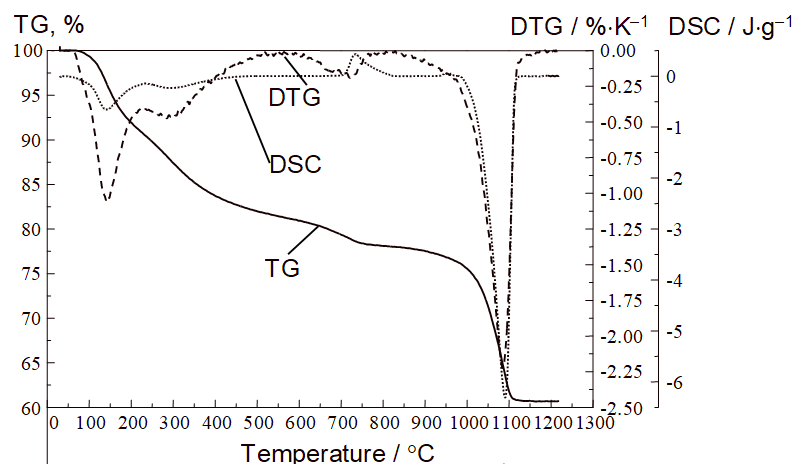
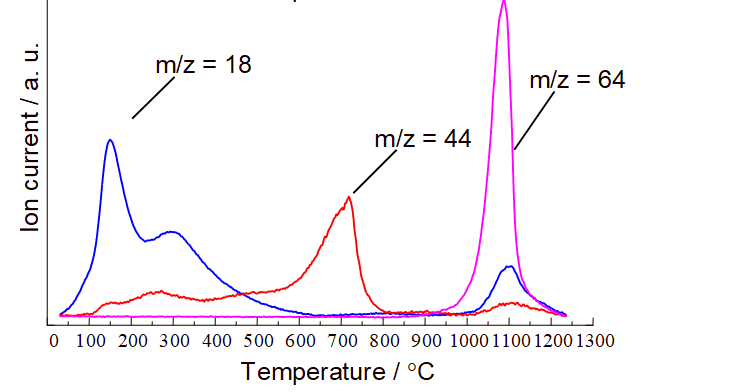
Таким образом, брутто-формула металлоксида, полученного гидролизом водного раствора соли, имеет вид:M(OH)a(An)b(CO3)c, где An – анион исходной соли (прекурсора), а коэффициенты a, b и c будут зависеть от валентности металла, его природы, природы прекурсоров и условий получения.
Примесные ионы разлагаются при нагревании, что хорошо видно по кривым термического анализа, совмещённым с масс-спектрометрическими кривыми газообразных продуктов термической деструкции. На рисунке показаны такие кривые для продукта гидролиза сульфата иттрия Y(OH)a(SO4)b(CO3)c. m/z–это отношение молекулярной массы частиц, попадающих в масс-спектрометр, к их заряду (заряд имеют все частицы, так как в масс-спектрометре газ попадает под действие пучка электронов). Нейтральные молекулы обычно имеют заряд, равный единице, таким образом m/z = 18, это вода, 44 – углекислый газ, 64 – SO2. Термическое разложение в данном случае идёт по схеме:
Y(OH)a(SO4)b(CO3)c → Y2O3 + H2O + SO2 + O2 + CO2 + O2
Из рисунка видно, что удаление воды заканчивается примерно при 600°С, затем удаляются карбонат-ионы, разлагающиеся с образованием углекислого газа, и, наконец сульфат-ионы, образующие при деструкции SO2.
Получение металлоксидов возможно не только из водных растворов. Очень хорошие результаты дают органические прекурсоры – алкоксиды металлов M(AlkO)x, где M – металл, Alk – алкильный радикал (метил, этил, пропил и пр.), x – валентность металла. Например, изопропоксититанTi(OiPr)4. iPr – изопропоксид(СH3 – CHO– – CH3).
Достоинства алкоксидов – успешный контроль пористости, удельной поверхности, дисперсии характеристик, т.е. получение материалов с заданными свойствами. Гидролиз алкоксидов приводит к образованию металлоксида и соответствующего спирта:
Ti(OiPr)4 + H2O → TiO(OH)2 + CH3–CHOH–CH3.
Нет проблем с противоионами, образующийся при гидролизе спирт легко удаляется во время сушке. Но существенными являются недостатки: высокая стоимость, необходимость использование инертной атмосферы, высокая токсичность, нестойкость и др.
После гидролиза следует стадия созревания гидрогеля. На этой стадии идёт структурирование – образуются поперечные связи между полимерными цепями, высвобождается и удаляется вода и возникает трёхмерная структурная сетка. Созревание может протекать в разных условиях и давать разные результаты. Гидрогель может выдерживаться при комнатной температуре или помещаться в сольвотермальные условия. Кроме того, как на стадии получения геля, так и при его созревании можно управлять структурообразованием путём замены растворителя – смешивания водного раствора с хорошо растворяющимися в воде жидкостями – спиртами, ацетоном, ацетонитрилом и пр.
Сольвотермальная (в случае воды – гидротермальная) обработка заключается в помещении гидрогеля в автоклав, который представляет собой стальной плотно закрывающийся сосуд со вставкой из фторопласта:

Обработка проводится при температуре 180…200°С при заполнении около 2/3 объёма. Давление в этом случае для водных систем составляет около 20 атм. Автоклавная обработка позволяет осуществлять контроль над размерами кристаллов, морфологией, степенью агломерированности различных оксидов путём тщательного контроля соотношения исходных прекурсоров, рН, продолжительности обработки и температуры. Можно добиться узкого распределения частиц и/или пор по размерам, высокой чистоты фазового состава.
Важным направлением при формировании структуры является применение структуронаправляющих и комплексообразующих веществ. К ним относятся и поверхностно-активные вещества (ПАВ), которые задают определённую структуру и заставляют полимерные цепи формироваться в нужном направлении. Карбоновые кислоты позволяют управлять структурообразованием металлоксидов и контролировать их форму и дисперсию характеристик. Комплексообразующие и структуронаправляющие соединения добавляют на начальном этапе, до гидролиза или во время его, затем, после созревания, отмывают растворителями или водой, и остатки разлагают (выжигают) при последующей температурной обработке высушенного геля (ксерогеля).
Температурная обработка гелей также вносит немалый вклад в формирование структуры конечного материала. При высушивании до температуры 200°С происходит удаление воды, содержащейся в порах и на поверхности материала. Выше 200°С удаляется вода, координационно связанная с атомами металла:
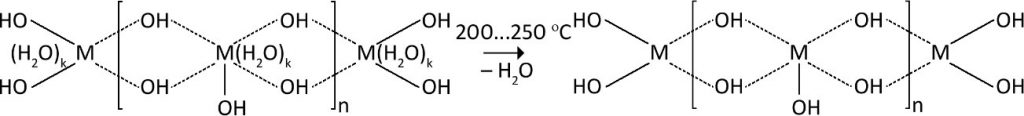
При ещё более высоких температурах молекула воды отщепляется от двухгидроксогрупп, расположенных рядом:
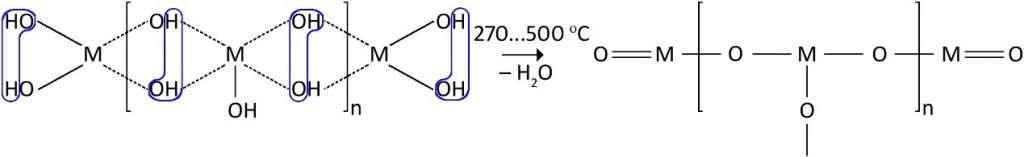
Эта вода называется химически связанной. В некоторых случаях химически связанная вода из внутренних областей материала удаляется ещё при более высоких температурах – до 600°С. Объём геля при этом сильно сокращается, трёхмерная структура может как упрочняться, так и разрушаться. Кроме того, в некоторых металлоксидах происходят фазовые превращения – перекристаллизация.
Итак, синтез металлоксида включает в себя:
- Гидролиз исходного прекурсора (органического или неорганического).
- Созревание, в том числе в сольвотермальных условиях, отмывку.
- Сушку и температурную обработку.
Далее полученные образцы изучают различными физико-химическими методами, в том числе определяют характеристики, необходимые для практического использования.
Физико-химические методы исследования могут быть самыми разнообразными, в зависимости от конечной цели получения металлоксидов.
Выбирая условия получения (концентрация, рН, время проведения процесса, температура, типы реагентов и пр.) можно управлять как структурой, так и поверхностными свойствами. На рисунках показаны некоторые образцы, полученные нашей научной группой:




>>Области применения металлоксидов